Zoutconcentratie beïnvloedt vorming amyloïde fibrillen
Nieuw resultaat kan bijdragen aan moleculaire verklaring voor ziekte van Parkinson
6 februari 2017
Het onderzoek werd uitgevoerd door promovendi Steven Roeters (Van 't Hoff Institute for Molecular Sciences, UvA, onder begeleiding van prof.dr. Sander Woutersen ) en Aditya Iyer (AMOLF, onder begeleiding van prof.dr. Vinod Subramaniam, VU).
Proces
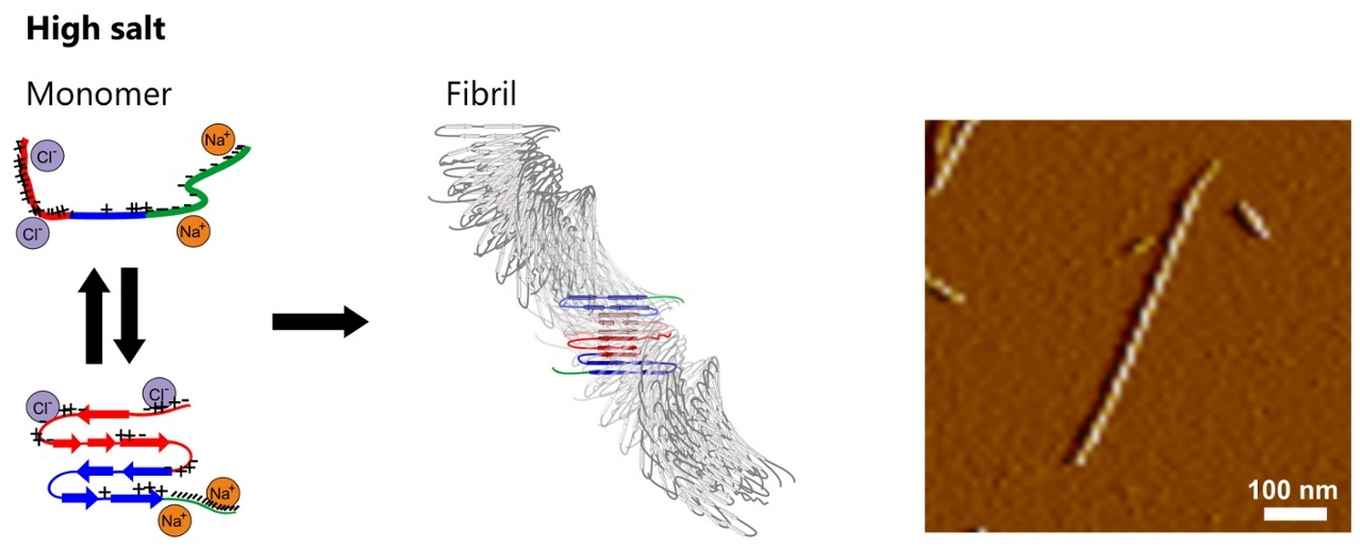
Ze bestudeerden de aggregatie van zogenaamde alpha-synucleine (αS) eiwitten tot amyloïde fibrillen, een proces waarvan bekend is dat het een rol speelt bij de neuronale degeneratie bij de ziekte van Parkinson. Met een combinatie van geavanceerde technieken zoals atoomkrachtmicroscopie (AFM), röntgendiffractie (XRD) en twee-dimensionale infrarood spectroscopie (2DIR), konden ze aantonen dat de structuur van deze αS fibrillen sterk afhangt van de zoutconcentratie tijdens het aggregatieproces.
Behalve bij de ziekte van Parkinson speelt de vorming van amyloïde fibrillen ook een rol bij zo'n vijftig andere aandoeningen, waaronder de ziekte van Alzheimer en diabetes type-II. De onderzoekers verwachten dat hun resultaten ook van betekenis kunnen zijn voor onderzoek naar de moleculaire achtergrond van deze ziektebeelden.