Methode gepubliceerd voor het maken van zeer helderrood fluorescerende eiwitten
15 januari 2020
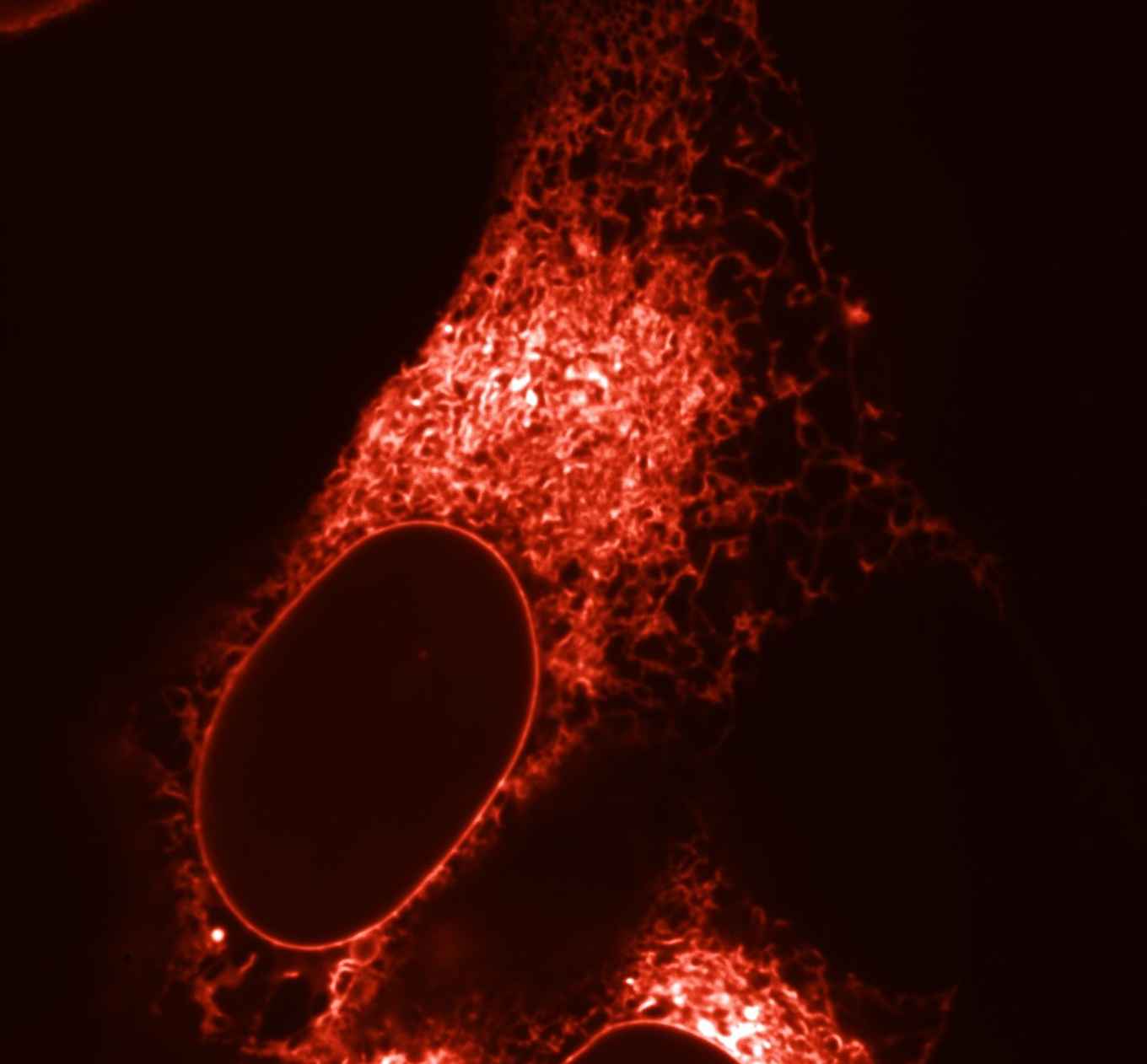
Fluorescerende eiwitten hebben een revolutie veroorzaakt in de celbiologie, omdat ze onderzoekers in staat stellen de dynamiek van cellen tot op moleculair niveau te visualiseren met behulp van microscopen. Fluorescerende eiwitten kunnen namelijk worden gekoppeld aan eiwitten die in de cel voorkomen: deze worden dan als het ware voorzien van een lampje zodat hun gedrag en precieze locatie in de cel kan worden gevolgd met een fluorescentiemicroscoop.
Er zijn intussen vele kleuren fluorescerende eiwitten beschikbaar, en door meerdere kleuren tegelijk te gebruiken en te koppelen aan verschillende structuren en eiwitten, kunnen meerdere processen tegelijk worden gevolgd in levende cellen. Alleen de rode fluorescerende eiwitten waren tot voor kort suboptimaal omdat ze samenklonterden in cellen en bovendien onvoldoende en te langzaam helder gingen fluoresceren. Deze eigenschappen moesten dus verbeterd worden.
Omdat rood fluorescerende eiwitten genetisch gecodeerd zijn in DNA, kunnen varianten worden gemaakt door de genetische code aan te passen. Op deze manier zijn eenvoudig miljarden verschillende varianten te maken. Maar daarbij zijn er een aantal problemen: hoe kies je uit die miljarden opties de beste variant, en hoe weet je dat er geen betere variant te maken is? En het grootste probleem: hoe vind je een variant waarbij niet een of twee maar alle eigenschappen optimaal zijn?. Er waren bijvoorbeeld al heel heldere rood fluorescerende eiwitten, maar die werden maar heel langzaam fluorescent, of die klonterden samen. Terwijl er ook rood fluorescerende eiwitten waren die snel fluoresceren en niet samenklonteren, maar die niet helder waren.
Dat is waar de UvA-biologen iets op hebben gevonden. De methode die nu is gepubliceerd door de onderzoeksgroep Moleculaire Cytologie, onder leiding van prof. Dorus Gadella, beschrijft een zogenoemd “multiparameter screening proces” waarbij meerdere eigenschappen van een groot aantal rood fluorescerende eiwitvarianten tegelijkertijd kan worden bepaald. Dit gebeurt in levende cellen, met behulp van geautomatiseerde fluorescentiemicroscopen en digitale beeldbewerking. In hun paper beschrijven Daphne Bindels, Marten Postma, Lindsay Haarbosch, Laura van Weeren en Dorus Gadella via een soort kookboek-recept in 75 stappen de juiste instellingen van de microscopen en hoe de beelden moeten worden bewerkt. Met deze methode is ook het zeer heldere mScarlet rood fluorescerende eiwit gemaakt (gepubliceerd in het vakblad Nature Methods).
Naast een gedetailleerd protocol is ook alle software-code beschikbaar gesteld aan de wetenschappelijke community voor het automatisch selecteren van de beste varianten. Gadella verwacht dat met behulp van dit protocol ook andere onderzoeksgroepen wereldwijd sterk verbeterde fluorescerende eiwitten en biosensoren kunnen gaan maken.