Eiwitfibrillen met een twist
Structurele analyse van amyloïde fibrillen die een rol spelen bij de ziekte van Parkinson
24 October 2017
Het onderzoek werd uitgevoerd door promovendi Steven Roeters (Van 't Hoff Institute for Molecular Sciences, Universiteit van Amsterdam, onder begeleiding van professor Sander Woutersen) en Aditya Iyer (AMOLF, onder begeleiding van professor Vinod Subramaniam, Vrije Universiteit). Ze werkten samen met Vladimir Kogan en professor Mireille Claessens van de Universiteit Twente (UT).
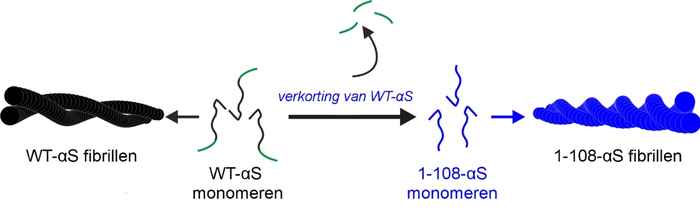
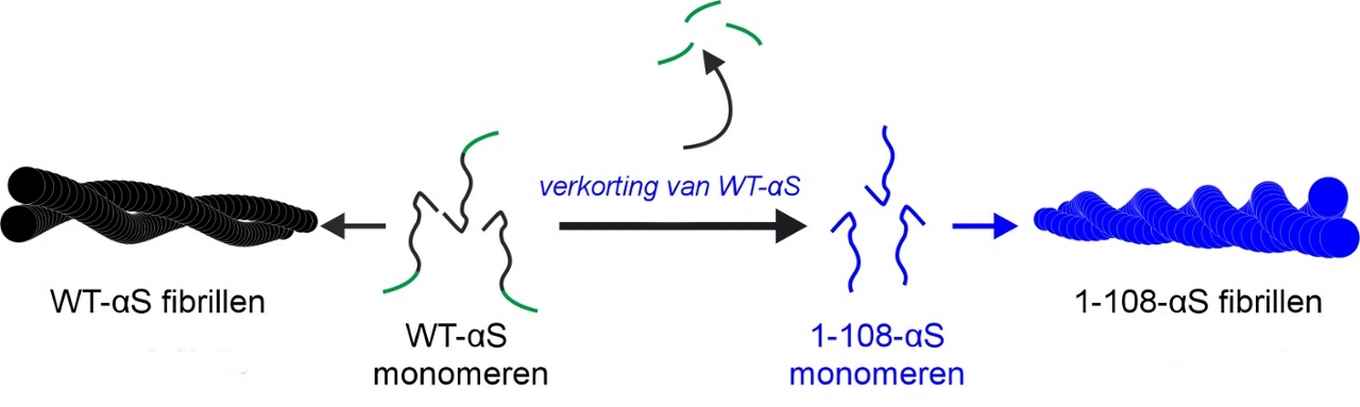
Met een combinatie van geavanceerde microscopische en spectroscopische technieken konden de onderzoekers de structuur van de fibrillen achterhalen en de verschillen aan het licht brengen. Ze hopen dat hun resultaten, met name die met betrekking tot het meer cytotoxische 1-108-αS eiwit (de vorm waarbij het einde eraf geknipt is), bijdragen aan een beter begrip van de moleculaire oorzaken van de ziekte van Parkinson en gerelateerde amyloïde ziekten.