Onderzoekers van UvA en Sanquin ontrafelen hoe witte bloedcellen door vaatwanden kunnen kruipen
13 september 2021
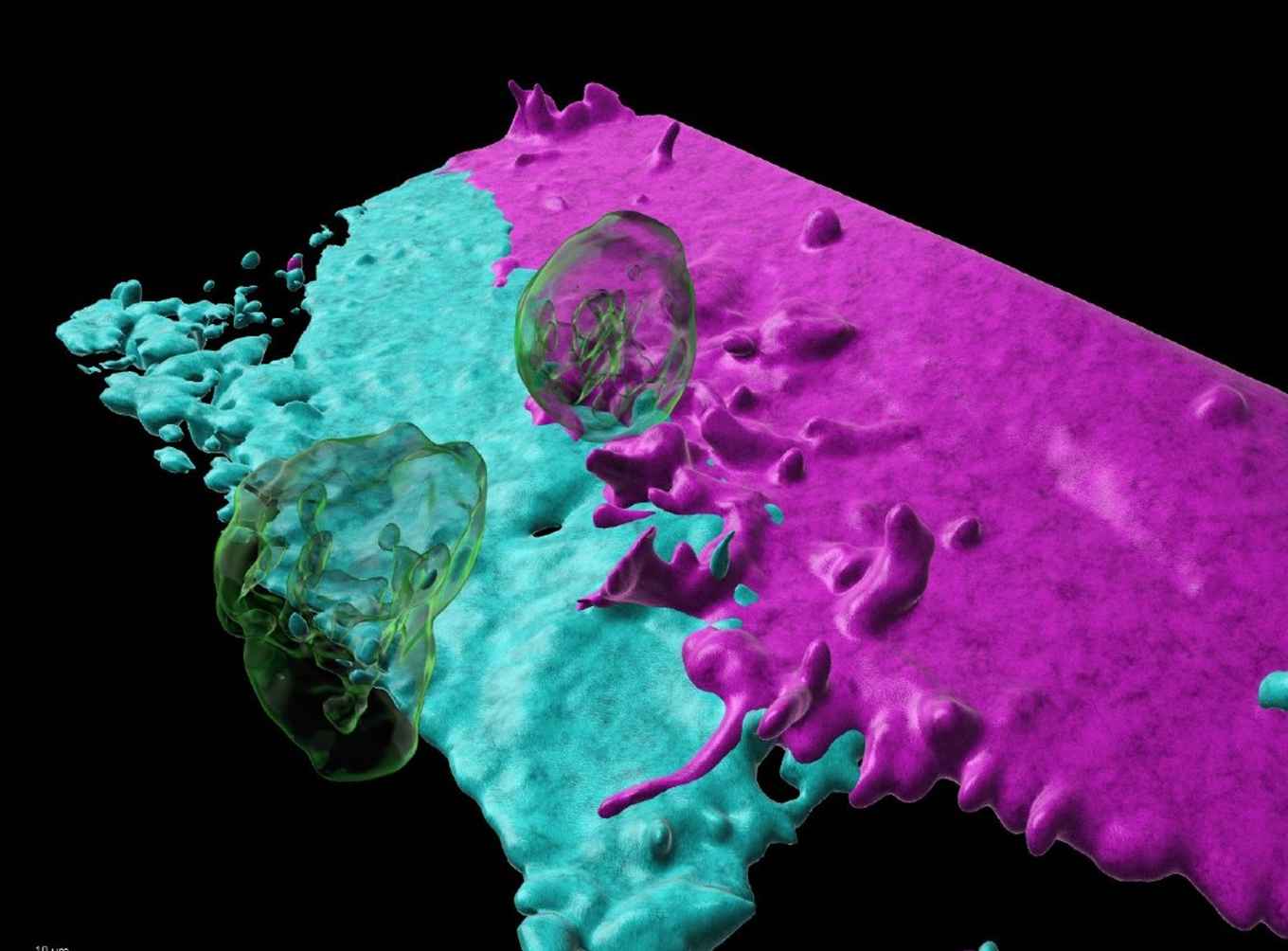
Het onderzoek bouwt voort op al langer lopend onderzoek door Van Buul en anderen naar de structuur van de wanden van bloedvaten en hoe de bloedvaten zelf een rol spelen bij het al dan niet doorlaten van bijvoorbeeld die witte bloedcellen. Van Buul legt uit: ‘Vroeger dachten we dat bloedvaten van binnen een mooie, gladde buis vormen. Als een soort PVC buis. Maar dat blijkt niet altijd zo te zijn. De wand van een bloedvat kan ook een structuur aannemen die je kunt vergelijken met schuurpapier, waar witte bloedcellen aan vast blijven zitten. Je ziet dan onder de microscoop dat de bloedcellen langs dat schuurpapier gaan kruipen, alsof ze ergens naar op zoek zijn. Dit gebeurt vooral onder ontstekingscondities. Ze kruipen door tot ze op een plek stuiten waar een soort kleine haartjes aanwezig zijn. Dat zijn de voorkeursplekken waar de witte bloedcellen graag door de wand heen gaan.’
Geavanceerde technieken
De nu verschenen studie, onderdeel van het proefschrift van Janine Arts (UvA & Sanquin) en gepubliceerd in het wetenschappelijke tijdschrift eLife, beschrijft wat er gebeurt op de plek van die haartjes. Voor het onderzoek waren twee state of the art technieken essentieel: een zeer geavanceerde microscoop en een in het laboratorium ontworpen moleculaire “switch” waardoor de onderzoekers de vorming van de haartjes konden sturen met behulp van licht.
‘Wij hebben ontdekt dat de vorming van die haartjes onder meer wordt gestuurd door een eiwit genaamd Rac1,’, vertelt Van Buul. ‘Teamleden van de UvA, Eike Mahlandt en Joachim Goedhart, hebben dat eiwit nagebouwd in combinatie met een soort lichtgevoelige sensor. Die zorgt ervoor dat het eiwit alleen actief wordt als je er licht van een bepaalde golflengte en intensiteit op schijnt. Zo konden we lokaal de aanmaak van die haartjes op de vaatwand sturen.’
Vervolgens konden de biologen bestuderen hoe witte bloedcellen op de plek van de haartjes door de vaatwand heen gaan. Dit proces gaat snel, en bovendien wil je het graag in 3D kunnen volgen. Het team week daarom uit naar de VS waar ze gebruik konden maken van een zogenoemde lattice light sheet microscoop. Deze geavanceerde microscoop is in staat om met een hoge frequentie beelden van een hoge resolutie te maken die tot een 3D beeld kunnen worden gecombineerd. ‘Het is de eerste keer dat we dit hele proces, inclusief de aanmaak van de haartjes, in zo’n detail hebben kunnen volgen’, aldus Van Buul.
Potentiële toepassing
De onderzoekers hopen dat met hun ontdekking in de toekomst bepaalde groepen van patiënten geholpen kunnen worden. Van Buul: ‘Er zijn bijvoorbeeld patiënten die lijden aan chronische ontstekingen, omdat hun lichaam niet in staat is voldoende witte bloedcellen op de plaats van de infectie te krijgen. We weten dat bij deze patiënten de witte bloedcellen onvoldoende aan de wanden van de bloedvaten blijven plakken. Mogelijk kan er, nu we in meer detail weten hoe het werkt met de vorming van de haartjes in de bloedvaten en hoe witte bloedcellen op plekken met deze haartjes door de vaatwand gaan, medicatie ontworpen worden die bij deze patiënten dit proces efficiënter maakt.’
Iets dergelijks geldt ook voor het verbeteren van immunotherapie voor kankerpatiënten. Van Buul: ‘Bij een van de vormen van immunotherapie krijgt een patiënt een grote hoeveelheid witte bloedcellen in de vorm van T-cellen toegediend. Maar de bloedvaten in de tumor zijn vaak slecht gedifferentieerd en laten die T-cellen niet zomaar toe tot het tumorweefsel. De huidige oplossing is om de patiënt extreem veel T-cellen toe te dienen, zodat er hopelijk toch genoeg de tumor bereiken. Maar als we ervoor zouden kunnen zorgen dat de bloedvaten in de tumor de T-cellen wel doorlaten, zou dat de therapie ook efficiënter kunnen maken.’
Details van de publicatie:
Janine JG Arts, Eike K Mahlandt et al, Endothelial junctional membrane protrusions serve as hotspots for neutrophil transmigration, in: eLife 2021, DOI: 10.7554/eLife.66074